Service de Médecine Nucléaire

La médecine nucléaire est l'ensemble des applications médicales des radiotraceurs, ou sources radioactives non scellées.
C’est une technique d’imagerie fonctionnelle, ce qui la distingue des techniques d’imagerie davantage morphologiques (imagerie par Rayons X, IRM, échographie).
Différents domaines d'application
Les différents domaines d'application sont :
- L'imagerie fonctionnelle in vivo qui consiste en l'administration d'un traceur radioactif au patient permettant sa détection externe. Ce sont les scintigraphies (émission de rayonnements gamma) ou les TEP (Tomographies d'émission de positons).
- Le diagnostic biologique in vitro : c'est de la radio-immuno-analyse.
- La radiothérapie métabolique : cela regroupe les applications thérapeutiques utilisant l'administration d'un produit radioactif dont le parcours dans la matière est suffisamment faible pour déposer son énergie directement au contact du tissu cible et de le détruire. exemple : la radiothérapie des cancers thyroïdiens par iode 131.
- La détection per opératoire: où le chirurgien se guide grâce à une sonde, lui permettant de vérifier que son intervention a bien retiré la totalité d'un tumeur dont les cellules ont capté le radioélément administré. (Exemple : le ganglion sentinelle).
Les Traceur
Les principaux radioéléments utilisés en pratique sont le 99mTc (technétium 99 métastable), le 201Tl (thallium 201), le 67Ga (gallium 67), le 111In (indium 111), l’ 131I (iode 131) ….. etc., et plus récemment, en routine clinique, le Fluor 18. Le technétium 99m est le radioisotope le plus utile en imagerie médicale nucléaire. Ses caractéristiques physiques sont presque idéales pour cette fin :
- la demi-vie de 6 heures est assez longue pour permettre de suivre les processus physiologiques d'intérêt, mais assez courte pour limiter l'irradiation inutile
- L'énergie du photon gamma de 140 keV est idéale puisqu'assez énergétique pour traverser les tissus vivants, mais assez faible pour pouvoir être détectée commodément : elle peut être interceptée efficacement par un cristal d'iodure de sodium dont l'épaisseur typique sera de l'ordre de 10 à 15 mm
- L'abondance de photon gamma est grande, environ 98% des désintégrations. Peu de particules non pénétrantes sont émises, limitant la dose d'énergie reçue par les tissus vivants.
Scintigraphie
Qu'est-ce qu'une scintigraphie ?
La scintigraphie est une technique d'imagerie utilisant des substances radioactives que l'on injecte à l'intérieur d'un organisme en quantité infime, et qui ont la propriété de se fixer sur les organes ou les tissus du patient. A l'aide d'une caméra spéciale appelée caméra à scintillation (gamma-caméra ), on enregistre le rayonnement qui est émis par l'organe ou le tissu : un appareil détecte les particules d'après les scintillations qu'elles produisent sur un écran. On obtient de cette manière une succession dans le temps de plusieurs images des organes intéressés, avec les anomalies ou altérations qui peuvent être la cause de la maladie. Il est possible de visualiser une évolution, une transformation voire un mouvement.


Qui peut passer cet examen ?
Tout le monde, du nourrisson aux personnes âgées, peut passer cet examen. Le produit injecté est en effet sans danger, y compris pour les personnes allergiques à l’iode.
Y a-t-il une préparation spéciale ?
En règle générale, il n’est pas nécessaire d’être à jeun pour passer une scintigraphie.
Des consignes particulières peuvent vous être données lorsque vous prendrez rendez-vous (arrêt d’un traitement ou régime sans poissons ni crustacés pendant la semaine précédant certains types d’examens).
Y a-t-il des contres indications ?
Cet examen est contre-indiqué pour les femmes enceintes. Si vous êtes enceinte ou avez un retard de règles, vous devez donc le signaler avant l’injection.
Si vous allaitez, signalez-le également : on vous indiquera pendant combien de temps vous devrez interrompre l’allaitement.
Comment se déroule l'examen ?
La scintigraphie se déroule en trois temps :
- on vous injecte, le plus souvent dans une veine du bras, une faible dose de produit radioactif ou "radiotraceur" ; ce n’est pas plus douloureux qu’une prise de sang
- vous attendez un certain temps entre l’injection et la prise de cliché ; ce délai peut varier de quelques minutes à plusieurs heures voire plusieurs jours
- on réalise les clichés de l’organe concerné grâce à un appareil appelé gamma caméra ; vous êtes assis ou allongé selon les cas et vous ne devez pas bouger ; en règle générale, vous pouvez rester habillé mais vous devez retirer tout objet métallique qui pourrait gêner.
A noter : la durée de la prise de clichés varie en fonction de l’organe et de la fonction examinée. Elle peut aller de 15 minutes à une heure.
Et après l'examen ?
Après la scintigraphie, vous pourrez vous alimenter normalement et reprendre vos activités, y compris conduire ou travailler. Le produit injecté ne provoque pas de somnolence.
On vous recommandera parfois de boire de l’eau pour éliminer plus vite et plus facilement le radiotraceur.
A noter : une scintigraphie ne correspond qu’à une très faible dose d’irradiation, comparable à celle reçue lors d’autres examens radiologiques.
Les scintigraphies les plus utilisées ?
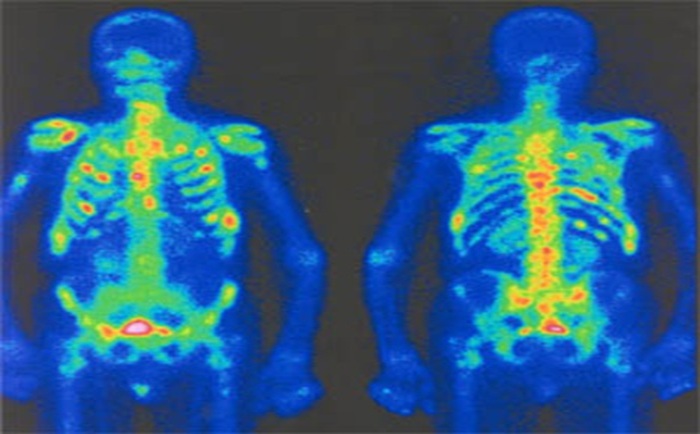
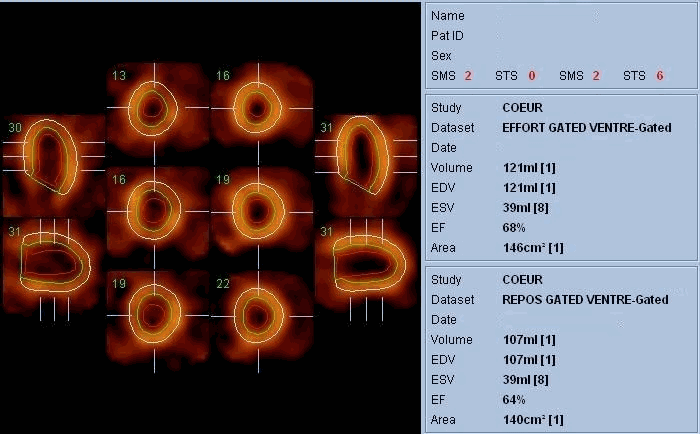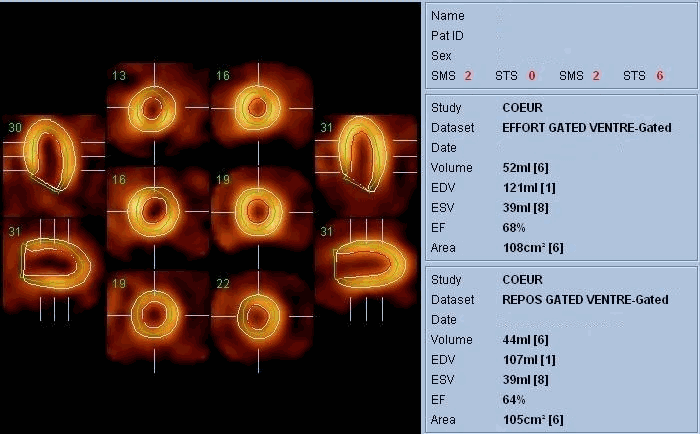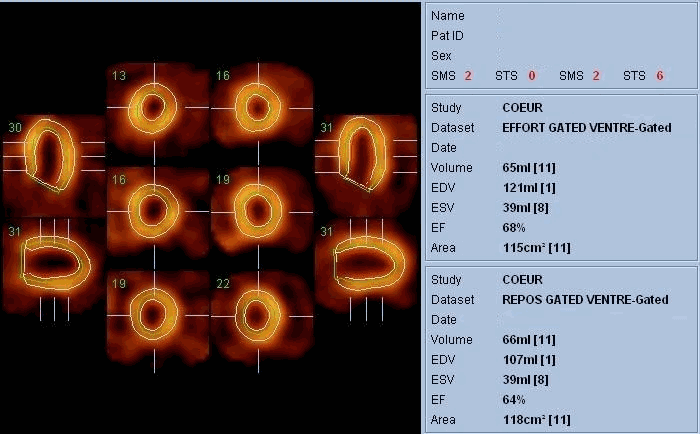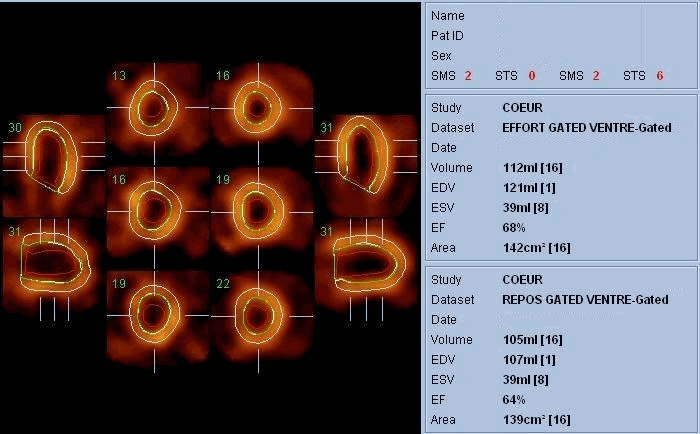
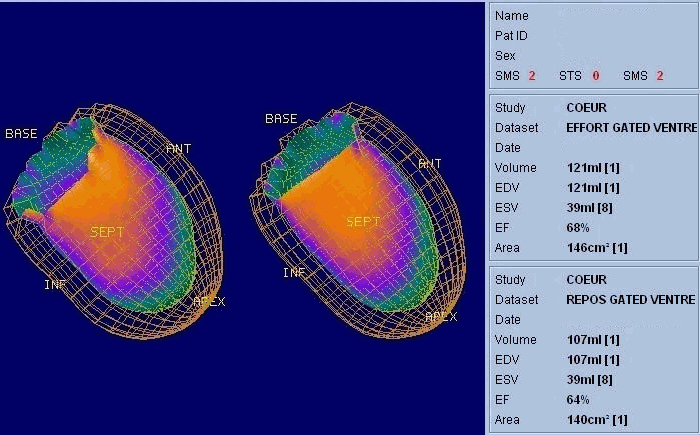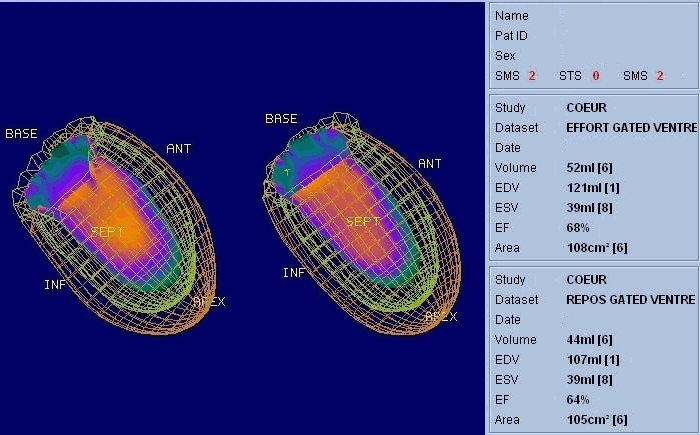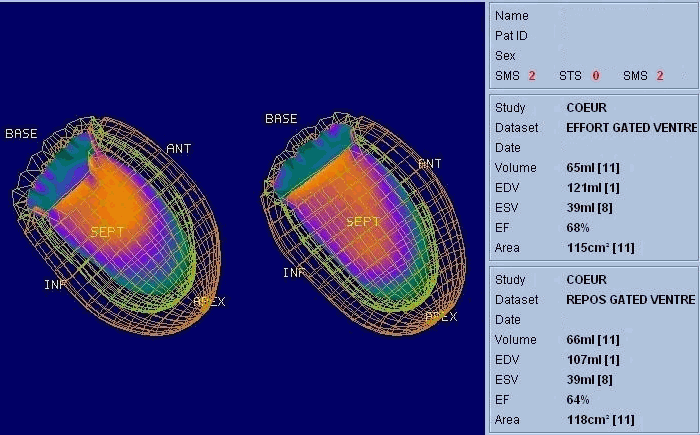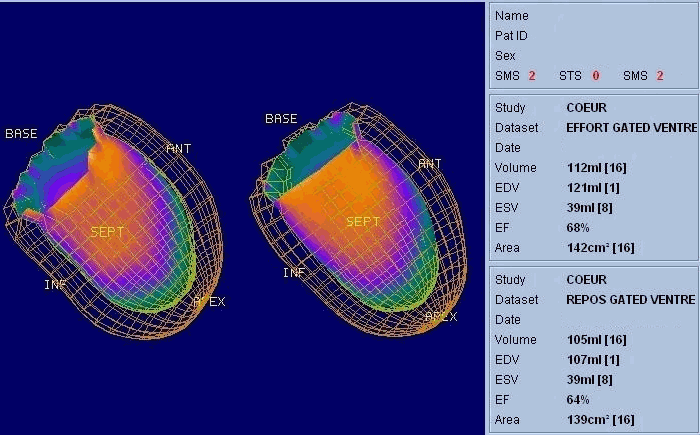
La scintigraphie thyroïdienne, la scintigraphie osseuse (image Sc.osseuse), la scintigraphie pulmonaire de perfusion et de ventilation, la scintigraphie myocardique (image Sc.coeur), la ventriculographie isotopique (image FEVG), la scintigraphie rénale dynamique et statique, la scintigraphie para thyroïdienne, la scintigraphie cérébrale, … ect.
Tomographie par émission de positons
- Qu’est-ce que c’est ?
La tomographie par émission de positons est un examen d’imagerie médicale qui permet de visualiser les activités du métabolisme, plus précisément des tissus, chez les humains. Elle diffère des technologies conventionnelles aux rayons-X et par résonance magnétique qui se limitent aux images de l'anatomie. Les changements physiologiques précèdent les changements anatomiques et, par conséquent, la tomographie par émission de positons permet de déceler à une phase plus précoce les dommages métaboliques et ainsi à aider à contrer leur progression. Les images sont obtenues par injection dans l’organisme d'une molécule radioactive marquée par des isotopes du carbone, du fluor ou de l'oxygène (émetteurs de positons).Cette technique permet de localiser, en chaque point d'un organe, une substance marquée par un radioélément administré à un sujet vivant, et de suivre dans le temps l'évolution de cette substance. Elle fournit ainsi une image quantitative du fonctionnement de l'organe étudié.
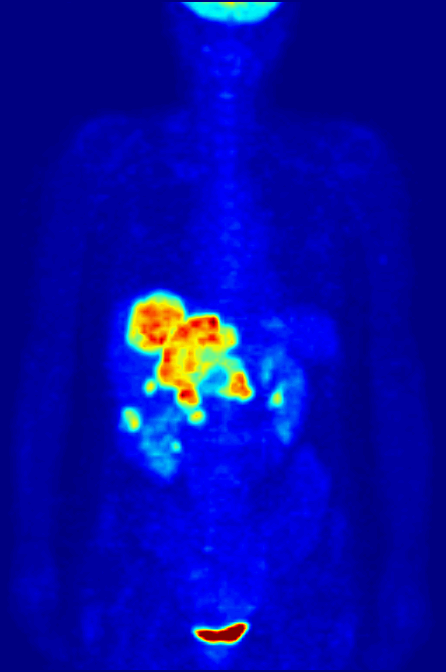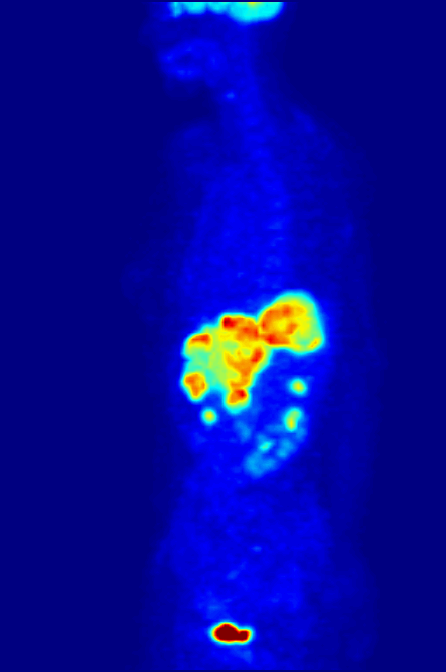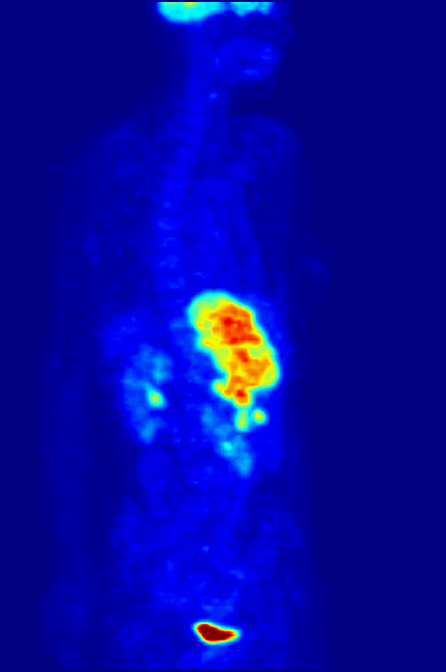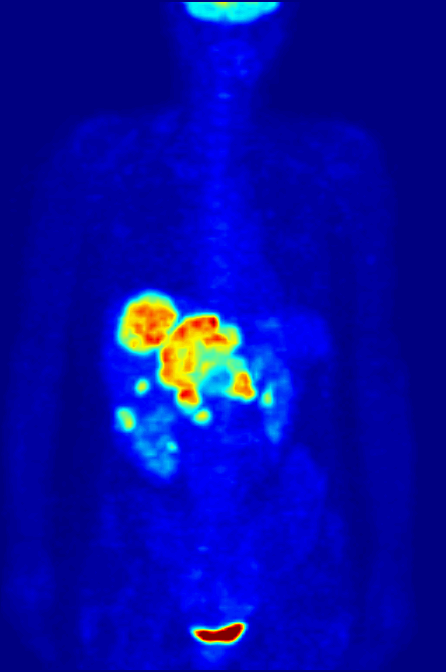
- À quoi ça sert ?
- Détecter un cancer ou étudier les effets du traitement du cancer.
- Un examen TEP du cœur peut être utilisé pour analyser le flux sanguin vers le muscle cardiaque et aider à évaluer les signes d’une maladie coronarienne.
- Déterminer si les zones du cœur qui montrent une diminution fonctionnelle sont vivantes ou bien nécrosées à cause d’un infarctus du myocarde antérieur. Combinée à un examen de perfusion myocardique, la TEP peut permettre de faire la différence entre un muscle cardiaque non fonctionnel et un muscle cardiaque qui pourrait bénéficier d’une intervention, telle qu’une angioplastie ou un pontage coronarien, permettant de rétablir un flux sanguin adéquat et d’améliorer la fonction cardiaque. - L’examen du cerveau évalue les patients qui présentent des troubles de la mémoire d’origine inconnue, ceux qui souffrent ou que l’on soupçonne souffrir d’une tumeur au cerveau et ceux qui souffrent de crises convulsives ne répondant pas à un traitement médicamenteux et qui sont donc des candidats à la chirurgie.
- Quel est le traceur le plus utilisé ?
Le 18F-FDG (fluorodesoxyglucose marqué au fluor 18) est un sucre semblable au glucose, rendu radioactif. C’est la radioactivité de ce fluor particulier rajouté au glucose qui permet sa détection par la caméra TEP. Les cellules cancéreuses se multiplient sans cesse. Ces nombreuses multiplications nécessitent beaucoup d’énergie ; elles ont donc une consommation anormalement élevée de glucose par rapport aux cellules normales. C’est grâce à cette consommation excessive de glucose que l’on peut repérer le tissu cancéreux avec la caméra TEP.
Le 18F-FDG se comporte comme le glucose, mais contrairement à celui-ci, il n’est pas une source d’énergie utilisable par la cellule cancéreuse. Il s’accumule alors dans la cellule qui devient radioactive. De plus, la molécule 18F-FDG est phosphorylée par la cellule qui « tente » de l'assimiler dans son métabolisme, ce qui l'empêche de ressortir de la cellule et le 18F-FDG-6P s'y accumule. En devenant radioactive, elle émet des rayonnements qui peuvent être détectés par la caméra TEP. Le tissu cancéreux est ainsi repéré grâce à l’accumulation du produit radioactif sous la forme d’une image d’hyperfixation.
Toutes les informations recueillies par la caméra TEP reposent sur la radioactivité repérée dans les tissus après l'injection du 18F-FDG au patient. Le système informatique relié à la caméra TEP produit des coupes et des images en trois dimensions des endroits du corps où le 18F-FDG s'est accumulé.
- Faut-il prendre des précautions avant ou après l’examen ?
Il faut être à jeun depuis au moins 6 heures avant le début de la perfusion. La contraction musculaire peut entraîner une fixation du FDG par le muscle et risque de gêner l'interprétation ; c'est la raison pour laquelle, il est demandé de rester parfaitement immobile et détendu. Avant l'enregistrement, la vessie doit être vidée.
Il n’existe généralement pas de restrictions concernant les activités quotidiennes que vous pouvez reprendre après l’examen, mais vous devriez boire beaucoup de liquides pour éliminer la substance radioactive.
Remarque : Les patients diabétiques devraient demander s’il doivent suivre un régime spécifique pour contrôler les taux de glucose le jour de l’examen.
- Comment se déroule l'examen ?
Une infirmière vous conduira dans une salle d’examen spéciale pour la TEP. Vous vous allongerez sur la table d’examen et on vous injectera la substance radioactive par voie intraveineuse. La substance mettra entre 30 et 60 minutes pour voyager dans votre corps et être absorbée par le tissu à étudier. Pendant cette période on vous demandera de vous reposer dans une pièce sombre et d’éviter d’effectuer tout mouvement important ou de parler, car cela pourrait fausser la région où la substance administrée va se concentrer. Puis la scintigraphie (prise d’images) commence. Cela prend de 30 à 45 minutes supplémentaires.
- Avantages et risques ?
En étudiant le fonctionnement du corps, la TEP peut aider les médecins à détecter des altérations de processus biochimiques suggérant la présence d’une maladie, et ce avant même que des changements sur le plan anatomique ne soient détectables par d’autres tests d’imagerie tels que le tomodensitogramme ou l’IRM.
Étant donné que la radioactivité a une durée de vie très limitée, votre exposition aux rayonnements est très faible. La quantité de substance radioactive est si faible qu’elle n’affecte pas le fonctionnement normal du corps.
La présence de la substance radioactive pourrait entraîner un risque d’exposition aux rayonnements pour le fœtus des patientes enceintes ou les nourrissons de celles qui allaitent. On devrait évaluer le risque encouru par le fœtus ou le nourrisson par rapport au gain potentiel d’information qui résulterait de la TEP. Si vous êtes enceinte vous devrez en informer le personnel du service d’imagerie TEP avant l’examen.
Radio-Immuno-Analyse (RIA)
- Qu'est-ce que la Radio-immuno-analyse ?
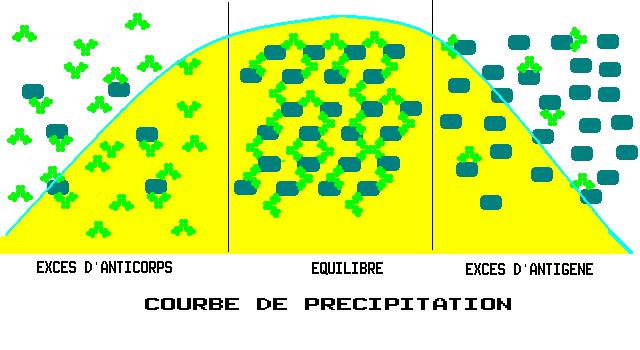
La RIA est une méthode d'analyse compétitive d'une grande précision basée sur la réaction de deux antigènes identiques (l'un deux étant marqué avec un radio-isotope) avec leur anticorps.
En médecine, elle est utilisée pour la détermination de la concentration d'hormones, d'antigènes, de médicaments, etc., dans le sang, l'urine ou les liquides biologiques.
Méthode d'analyse compétitive d'une grande précision basée sur la réaction de deux antigènes identiques (l'un deux étant marqué avec un radio-isotope) avec leur anticorps.
En médecine, elle est utilisée pour la détermination de la concentration d'hormones, d'antigènes, de médicaments, etc., dans le sang, l'urine ou les liquides biologiques.
Matériel : Il est essentiel qu'un laboratoire de RIA possède un compteur gamma à scintillation fiable.

Radiothérapie Métabolique
- Qu’est-ce que c’est ?
La radiothérapie métabolique ou radiothérapie interne vectorisée est une modalité thérapeutique qui consiste à irradier des cibles tumorales de petite taille et disséminées dans l’organisme au moyen de médicaments radioactifs (radiopharmaceutiques) injectés par voie intraveineuse, marqués par des radionucléides émetteurs de rayonnement particulaires, et dont les propriétés biologiques conduisent à un ciblage sélectif des cellules tumorales. Ces radiopharmaceutiques vont se fixer sur un tissu cible pour y délivrer une irradiation Bêta dans un but thérapeutique, curatif ou palliatif.
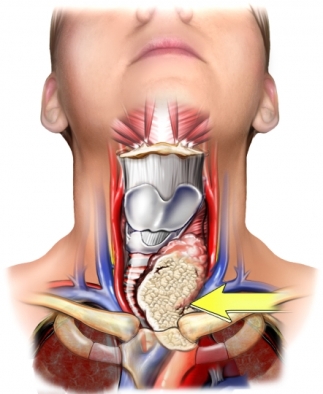
- Iode 131 et cancer de la thyroïde ?
La totalisation isotopique correspond à la destruction des reliquats thyroïdiens restant aprés une thyroïdectomie totale. Elle est réalisée grâce à une dose d’iode 131, dite dose ablative, administrée selon certaines conditions afin de favoriser la captation par le tissu thyroïdien et moyennant des mesures spécifiques de radioprotection. Elle n’est pas systématique, elle est indiquée après thyroïdectomie totale ou quasi-totale, chaque fois que l’âge du patient, l’extension de la tumeur appréciée par la classification TNM, le taux de la thyroglobuline, le type histologique et/ou la multifocalité font craindre une maladie résiduelle post opératoire, une extension à distance ou un risque d’évolution ultérieure.
Ce traitement ne doit être administré que dans les centres convenablement équipés pour cela, disposant de chambres radio-protégées et de matériel de détection et de radioprotection appropriés. L’activité d’iode 131 administrée est comprise entre 1100 MBq (30 mCi) (activité faible) et 3700 MBq (100 mCi) voire plus (150 mCi), notamment en cas de localisations secondaires associées. Les contre-indications absolues de la radiothérapie métabolique à l’iode 131 sont la grossesse et l’allaitement.
- Les métastases osseuses douloureuses ?
Chez les patients présentant des métastases osseuses généralisées douloureuses, la Radiothérapie Métabolique offre une stratégie analgésique prometteuse. Elle consiste à irradier de manière sélective des cibles tumorales de petite taille et disséminées dans l’organisme au moyen de médicaments radioactifs, injectés par voie intraveineuse et marqués par des radionucléides émetteurs de rayonnement β-. Le tissu cible est ici représenté par la réaction osseuse périmétastatique.
Actuellement deux radiopharmaceutiques sont disponibles en pratique clinique et autorisées (AMM): le chlorure de strontium 89 (Metastron®) et le samarium-153-éthylène diamine tétra-méthylène diphosphonate ou (Quadramet®). L'AMM du Métastron est limitée au traitement antalgique des métastases osseuses d'origine prostatique en échappement hormonal. Celle du Quadramet s'étend aux métastases osseuses détectables par la scintigraphie osseuse quelle que soit l’origine du cancer primitif.
Ces produits ont des objectifs uniquement palliatifs : apaiser les douleurs des métastases osseuses, retarder l’apparition de nouvelles métastases douloureuses, éviter certaines complications comme l’hypercalcémie ou les fractures, éviter d’autres traitements à visée antalgique (opiacés, radiothérapie hémi-corporelle) complexes, coûteux, plus ou moins efficaces, non dénués d’effets secondaires. L’utilisation de la RTM se fera après avoir éliminé un envahissement médullaire avancé, une thrombopénie inférieure à 100 000 plaquettes/mm3 et une leucopénie inférieure à 2 000 globules blancs/mm3. De même, toute suspicion de coagulopathie de consommation doit être écartée avant le traitement.
- La Radioimmunothérapie ?
Les lymphomes malins non Hodgkiniens (LMNH) sont des tumeurs malignes du système lymphoïde. Ils touchent tous les âges de l’enfance mais sont exceptionnels avant 2 ans.
La radio-immunothérapie est une forme de radiothérapie interne utilisant comme agent de vectorisation un anticorps monoclonal, reconnaissant un antigène exprimé par les cellules tumorales, couplé à un radionucléide. Les antigènes CD20 sont présents à la surface des lymphocytes B normales et cancéreuses. Deux molécules ont été développées dans le traitement par des lymphomes non hodgkiniens : l’anticorps monoclonal murin anti-CD20 marqué à l’yttrium-90 (Zevalin) et l’anticorps monoclonal murin anti-CD20 marqué à l’iode 131 (Bexxar).
C’est un traitement sélective qui permet d’irradier et de détruire les cellules tumorales sans atteindre les tissus sains de voisinage, contrairement à la chimiothérapie et à la radiothérapie externe. L’efficacité est proportionnelle à la quantité d’anticorps radioactifs injectée. La RIT est indiquée dans le traitement des lymphomes folliculaires CD20 positifs en rechute ou réfractaires aux traitements par radiothérapie et chimiothérapie.
- La méta-iodobenzyguanidine (MIBG) ?
La méta-iodobenzylguanidine (MIBG) est un dérivé de la guanéthidine. Il s’agit d’une molécule structurellement proche de la noradrénaline qui, une fois injectée, s’accumule sélectivement dans les organes sécrétant des catécholamines (médullosurrénales, paraganglions sympathiques, fibres nerveuses du système sympathique) et dans les tumeurs qui dérivent de ces organes (phéochromocytomes, neuroblastomes, paragangliomes sympathiques, carcinomes médullaires thyroïdiens, tumeurs carcinoïdes).
La MIBG marquée à l’iode 131 est utilisée comme agent de thérapie radiométabolique dans les tumeurs dérivées du neuroectoderme, en cas d’échec des modalités de traitement conventionnelles.
A cause de son efficacité limitée, l’administration d’une haute activité de MIBG- I131 (1 à 5 GBq) dans un but thérapeutique est à l’heure actuelle réservée à des enfants porteurs de neuroblastome à un stade avancé, réfractaires à toute thérapie conventionnelle et dans un but exclusivement palliatif. Le traitement nécessite une hospitalisation d’une semaine en chambre radioprotégée, ainsi qu’une protection thyroïdienne par du Lugol ou de l’iodure de potassium.
- Les analogues de la somatostatines ?
Les tumeurs neuro-endocrines surexpriment un grand nombre de récepteurs membranaires pour les peptides, comme la somatostatine, la gastrine ou le CRP. Des analogues radiomarqués de ces peptides pourraient permettre d’irradier sélectivement ces tumeurs.
La plupart des tumeurs endocrines expriment des récepteurs pour la somatostatine et en particulier le sous-type 2, notamment les tumeurs endocrines dérivées de l’endoderme digestifs ou gastro-entéropancréatiques (TED). Cette propriété est utilisée pour leur diagnostic et leur traitement. Actuellement, les seuls peptides utilisés pour la radiothérapie métabolique des tumeurs endocrines sont les analogues de la somatostatine.
L’octréotide est un analogue retard de la somatostatine qui a une forte affinité pour le sous type 2 des récepteurs. Il représente le principal traitement symptomatique des tumeurs sécrétantes. L’octréotide radio marqué à l’indium 111 (octréoscan) à fortes doses (jusqu’à 100 GBq d’activité cumulée) est utilisé dans un but thérapeutique chez des patients porteurs de tumeurs endocrines évoluées en échec des traitements conventionnels.
- Le Lipiocis et les microsphères chargées d’yttrium 90 ?
Le carcinome hépatocellulaire est le plus fréquent des cancers primitifs du foie. Il survient presque toujours sur une maladie hépatique préexistante, exceptionnellement sur un foie sain : cirrhose dans plus de 90 % des cas et plus rarement hépatopathie chronique non cirrhotique, le plus souvent virale (hépatite B ou C chronique) mais aussi alcoolique.
Le lipiodol (Esters éthyliques des acides gras) marqué à l'iode 131 (Lipiocis®) peut être administré localement après une artériographie sélective ou hypersélective pour le traitement palliatif du carcinome hépatocellulaire avec thrombose portale. Injecté par voie intra-artérielle hépatique, le Lipiocis® suit le flux artériel préférentiellement vers la formation tumorale dont il embolise les microvaisseaux, et le reste se répartit dans le volume hépatique non tumoral. Ainsi, le Lipiocis® se trouve à une concentration plus élevée dans la tumeur que dans le foie non tumoral. Les propriétés cytotoxiques dues au rayonnement β- émis par le radionucléide iode-131, entraînent par irradiation une régression tumorale et une réduction du thrombus néoplasique, potentialisées par l'ischémie locale due aux propriétés physico-chimiques du Lipiocis®.
Les microsphères sont des microbilles inertes d’une trentaine de microns de verre ou de résine (TheraSphere et SIR-Spheres) sur lesquelles l’yttrium 90 est adsorbé. Elles sont injectées par voie intra artérielle en amont de lésions tumorales hépatiques uniques ou multiples. Après injection, les microsphères peuvent se répandre dans tout le foie ou se limiter à certaines zones, où elles se logent dans les artérioles hépatiques pour bloquer l’apport de sang à la tumeur par embolisation des vaisseaux sanguins qui nourrissent la tumeur. Transportées directement par la circulation sanguine dans les tumeurs du foie où elles s’implantent, elles y émettent leurs rayonnements qui détruisent uniquement la tumeur en épargnant majoritairement le tissu sain du foie, permettent ainsi une irradiation ciblée des tumeurs. De cette façon, les cellules cancéreuses sont irradiées avec une dose beaucoup plus forte pendant une période plus longue. C’est un traitement palliatif émergent du cancer hépatique primitif inopérable, ce traitement permet de ralentir l’évolution de la maladie, voire même parfois de réduire la taille des lésions au point de rendre l’exérèse chirurgicale ou la transplantation possible.
Détection per opératoire
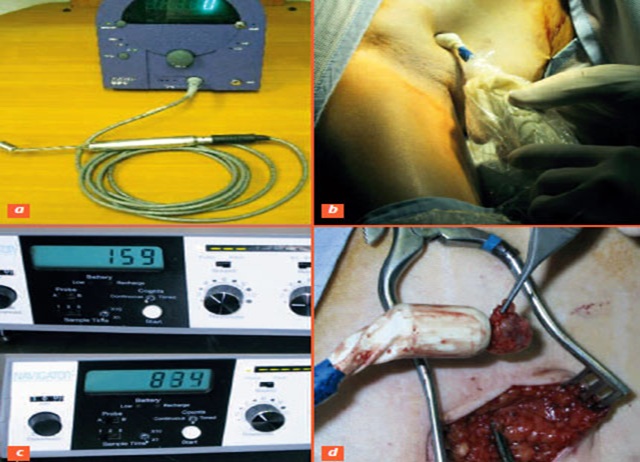
Recherche du ganglion sentinelle par lymphoscintigraphie
- Indications
Recherche du premier relais ganglionnaire dans les tumeurs du sein de petite taille (moins de 2 cm) ou dans les mélanomes. Ce ganglion correspond au premier relais de drainage lymphatique de la tumeur. Son analyse anatomopathologique permet de guider le geste chirurgical (chirurgie extensive ?).
-
Préparation du patient
Explication du déroulement de l'examen et de son intérêt au cours d'un entretien préalable avec le médecin isotopiste.
Désinfection locale par la Bétadine® avant les injections.
- Produit injecté
On utilise un colloïde, le sulfure de Rhénium, qui est injecté en péri-tumoral pour les mélanomes, ou en sous-cutané dans la région sous-aréolaire dans le cancer du sein. On pratique plusieurs injections de radiotraceur (une par quadrant pour le cancer du sein).
Ce produit est capté, puis drainé par le système lymphatique. Il permet ainsi de marquer les vaisseaux et les ganglions lymphatiques.
La patiente (ou le patient) doit impérativement pratiquer un massage de 10 mn de la région où ont été pratiquées les injections pour activer le drainage lymphatique (compresses alcoolisées).
- Dose injectée
500 µCi par injection dans 0,5 ml de sérum physiologique.
La dose doit être adaptée à l'heure de la chirurgie (le jour même ou le lendemain). Acquisition
Dans le cancer du sein, la patiente est placée en décubitus dorsal. Plusieurs acquisitions statiques sont centrées sur le sein pathologique avec une caméra double ou simple tête environ 30 à 60 mn après les injections.
Ces incidences sont répétées dans le temps si le ganglion sentinelle n'est pas mis en évidence.
Le nombre d'images dépend donc de la rapidité d'apparition du ganglion sentinelle.
Dans le mélanome la position du patient et les incidences dépendent de la localisation.
- Eléments techniques
Acquisitions statiques : incidences face antérieure, oblique antérieure et profil du côté pathologique avec une caméra double tête, collimateurs LETHR ou une caméra à une seule tête, collimateurs LEHR ; photopic 140 KeV ; zoom 1 ; matrice 256 X 256 ; 2 à 3 mn par image.
- Durée totale de l'examen
Durée totale de l'examen : entre 2 h et 4 h en fonction de la rapidité de détection du ganglion sentinelle.
- Procédure particulière
Dans le service de Médecine Nucléaire, le ganglion sentinelle mis en évidence, est repéré sous la caméra, puis au moyen d'une sonde gamma collimatée et un marquage cutané indélébile est réalisé pour guider le chirurgien.
Au bloc opératoire, le ganglion sentinelle est repéré par le chirurgien au moyen de la sonde d'exploration, ce qui guide son prélèvement.